

Vand, pH og non-kovalente bindinger 2![]()
![]() Protonspring i vand.
Protonspring i vand.
Da der er så små mængder af H+ og OH- i vandet, er det sjældent de gør bekendtskab og modvirker hinanden. Ka = pKa er den negative logaritme af Ka. Stærk (kraftig) syre har færre pKaer . Se ovennævnte ligning, hvor det kan ses at når [A-] = [HA], derefter Ka = [H+]. Så pKa = pH. Det er basis for Henderson-Hasselbalch ligningen: Titreringskurverne pKa1 pKa2 pKa3 H3PO4 H2PO4- + H+ HPO4-2+ H+ PO4-3 + H+ -
Ligevægts konstanten Keq beskriver ioniseringsbalancen af vandet:
Keq = [H+][OH-]
Af hensyn til dette forhold (også kaldet 'slægtskab'), er det vigtigt at bemærke, at hvis [H+] stiger (går op) må [OH-] sænkes (gå ned), for at værdien Keq i vandet kan forblive konstant.
I neutral vand vil Keq være 1 x 10-14 M og koncentrationen af [H+] og [OH-] er hver 1 x 10-7 M. Lad os se på de sidste tal uden eksponent:
0.0000001 M
Det er så absolut et meget lille tal. En mere overkommelig måde at forklare små tal som disse på, er at tage den negative logaritme. For koncentrationen af [H+], hvilket også kaldes pH. I dette tilfælde:
-log(0.0000001 M) = 7
pH opløsningen er simpelthen den negative logaritme af [H+]. pH værdien i opløsningen beskrives som surhed (acidity). Surhed i opløsningen er disse med en pH som er mindre end 7, og basiske opløsninger har en pH værdi som er større end 7.
En opløsning som H2O med en PH = 7 er neutral.
På lignende måde kunne pOH benyttes til at forklare en opløsning for betegnelsen af dets OH- koncentration.
pOH er den negative logaritme af OH- koncentrationen. En brugbar ting at huske er:
pH + pOH = 14
Blodet i den menneskelige krop er 7.4. Det svarer til en [H+] på omkring 40 nM.
Værdien kan kun variere fra 37 nM til 43 nM uden alvorlige stofskifte konsekvenser.
pKa
I levende organismer, involveres megen kemi mellem syre og base. Syre (Acids) er H+ som donorer (giver) og baser er H+ acceptanter.
HA ![]() H+ + A-
H+ + A-
Syre og base reaktioner er sammensat af konjugerede syre-base par. Stærk syre er de, som beredvilligt og let afgiver en H+.
Stærk base, er de som accepterer en H+. Svag syre afgiver ikke beredvilligt en H+, men kun under de rette betingelser.
En svag base er en som ikke uden videre accepterer en H+. Konjugeret base for en stærk syre, er en svag base.
I modsætning hertil, har en stærk base en svag syre som dets konjugere. Tænk på stærk syre, som en person med en hæslig grim paryk. Personen kan simpelthen ikke vente med at rive den af hovedet. Så nu har vi en hæslig grim (H+) og en person uden paryk (den svage base). Du er klar over, at personen uden paryk, virkelig ikke ønsker at tage det tilbage!
Men hvad med den stærke base-svage syre konjugerende par?
A- + H+ ![]() HA
HA
Tænk på det i lignende situationer: en person med et skrækkeligt behov for en paryk, vil tage det uanset hvad. Det er vor stærke base. På den anden side af opløsningen, har vi en eller anden med en paryk som virkelig ikke ønsker at afgive den, akkurat som svag syre ikke ønsker at skille sig af med dets H+ .
* Vi kan tænke på en stærk syre eller base som har en "bagside", hvilket henholdsvis er dets svage base eller svage syre konjugering.
Hvor let kan en syre opgive dets H+ er et udtryk for syre konstant adskillelsen, eller Ka : [H+][A-]
[HA]pH =pKa + log[H+][A-]
[HA]![]() Henderson-Hasselbalch
Henderson-Hasselbalch
Ligningen Når syre eller base tilføres en opløsning, vil det forandre pH værdien.
Når syre eller base tilføres en opløsning, vil det forandre pH værdien.
En kontrolleret tilførsel af en syre eller base til en opløsning, kaldes en titration. En titration kurve kan fremstilles ved at tegne pH forandringerne mod omfanget af syre eller base der tilføres opløsningen.
Mange titrationskurver laves ved at tegne pH på y aksen og omfanget af basen der tilføres opløsningen på x aksen. Eksempel:
pH forandringer til eddikesyre, CH3COOH, og saltsyre, HCI, med 0.1M natriumhydroxid, NaOH, som vist til højre. Bemærk formen i kurven. CH3COOH starter på et højere pH end HCI kurven. Dette skyldes, at CH3COOH er svagere syre end HCI.
Når NaOH tilføres opløsningen af CH3COOH, stiger pH niveauet. Når der imidlertid tilføres NaOH til HCI opløsningen, sker der ikke nogen nævneværdig ændring af pH’en. Der bruges mindre NaOH for at ændre pH værdien i en svag syre opløsning, end det gør for at ændre pH værdien i en stærk (kraftig) syre opløsning.
Al syre i begge opløsninger vil til sidst have reageret med base, som sådan hurtig vil forøge pH værdien når der tilføres mere base. Det kaldes det ækvivalente punkt. Det er punktet hvor al syre har reageret med basen, så at yderligere tilføjelse af base hurtigt forøger pH værdien. Det ækvivalente punkt for en kraftig syre-stærk base titrering er pH = 7. For svag syre-stærk base titrering, vil det ækvivalente punkt være pH > 7.
Buffere
Som vist ovenfor, er pH i en opløsning afhængig af koncentrationer af H+ ioner.
Ekstra eller færre H+ ioner, kan i høj grad påvirke pH i en opløsning.
I den menneskelige organisme (kroppen) kan pH i cellernes ekstracellulærvæske variere fra en pH på 8 i bugspytkirtlens væske til en pH på 1 i mavesyren.
Den gennemsnitlige pH i blodet er 7.4 og i cellerne fra 7.0 til 7.3. Selvom der er stor variation af pH mellem væskerne i kroppen, er der dog kun et mindre afveksling i hvert system.
For eksempel varierer pH i blodet kun mellem 7.35 til 7.45 (i et sundt og sygdomsfrit legeme). Større ændringer af pH niveauet kan være livstruende.
Hvordan opnår legemet at holde en konstant pH niveau i blodet?
Kroppen benytter sig af et buffer system, for at modstå ændringer i pH. Buffere består af en blanding mellem svag syre med dets konjugerende base eller svag base med dets konjugerende syre. Husk at syre donerer (afgiver) en H+ ion.
En svag syre vil ikke uden videre donere dets H+ ion. På samme måde er det med en svag base, som ikke vil acceptere (modtage) en H+ ion, ligesom den stærke (kraftige) base umiddelbart ville gøre. 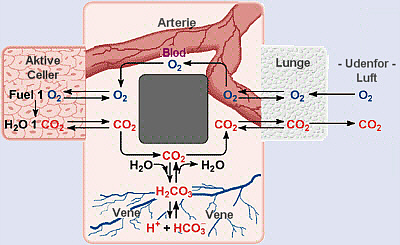
![]() Bikarbonatets blodbuffer system
Bikarbonatets blodbuffer system
Buffere opretholder pH ved en binding af H+ eller OH- ioner. Dette stabiliserer ændringer i pH. Bikarbonatbufferen opretholder blodets pH til tæt på 7.4. Kulsyre, H2CO3, i blodet er i ligevægt med kuldioxid (CO2) i luften.
Buffere er mest effektive i et pH område nær dets pKa. Det er her titreringskurven er mest overfladisk, og hvor pH-værdien er mindst påvirket af tilsat syre eller base.
I titreringskurven for fosforsyre, (et andet blod buffer system): ![]()
![]()
![]()
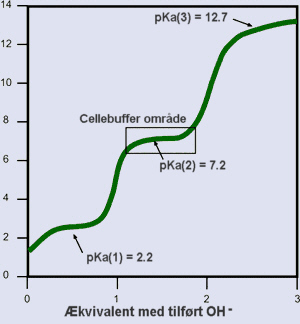
![]() Titrering af en polyprotic svag syre.
Titrering af en polyprotic svag syre.
Regionen i det rektangulære område er bufferområdet i biologisk betydning.
Bemærk at hældningen af kurven er lavvandet i en pH-enhed af pKa værdien.
Det er her hvor bufferkapaciteten er mest effektiv, hvilket betyder, at bufferen er i stand til at modstå ændringer i pH.![]()