


 |  |
Alle hjørner på metan, der udgør punkterne i en pyramide, er besat af en brint.
Men kun to hjørner i vand er besat med brintatomer.
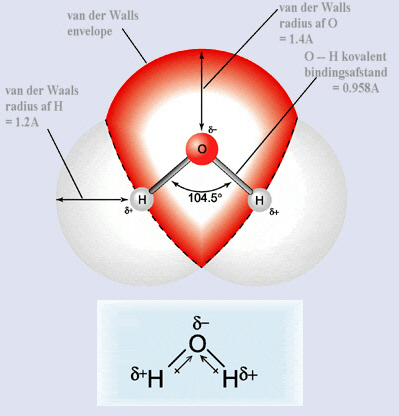
De to andre hjørner er hver især besat af et ensomt par elektroner. Dette forhold bevirker, at vandmolekylerne vil have en bøjet molekylær form.
Ilt er stærkt elektrofil (elektron kærlig). Dette betyder, at selvom ilten i vandet er bundet til hvert af brintatomerne via kovalente bindinger (deler et par af elektroner), ”trækker ” ilt de delte elektroner tættere til sig selv.
Denne ulige fordeling af elektronerne i O-H obligation (forbindelser) i vand, forårsager at brintatomerne delvist bliver positivt ladet (positiv dipol), og at ilt bliver delvist negativ ladet (negativ dipol).
Vand kaldes et polært molekyle, fordi det har en positiv side og en negativ side, der kaldes en dipol-moment.
I modsætning til carbon (kulstof) i methan, deles elektronerne ligeligt mellem de 4 brintatomer.
Metan har ikke en dipol-moment, og i modsætning til vand, er det ikke-polært.
 |
Vandmolekyler har både en delvis positiv og en delvis negativ ladet side.
Det betyder, at vandmolekylerne tiltrækkes af hinanden, ligesom de positive og negative sider på en magnet.
På grund af disse attraktive kræfter, er vandmolekyler i umiddelbar nærhed af hinanden, hvilket gør vandet meget tæt. Metan molekyler har ikke en dipol attraktion til hinanden, og er derfor i længere afstand fra hinanden.
På trods af den samme størrelse og masse af vand, er metan meget mindre tæt end vand.
Det er derfor at vand eksisterer som flydende væske ved stuetemperatur, mens metan er en gas.
Vi ved, at vand kan omdannes til det luftformige gas, damp, men kun ved at anvende en mængde energi i form af varme, som opløser vandmolekylernes stærke tiltrækning til hinanden.
Hydrogen binding (brintbindinger)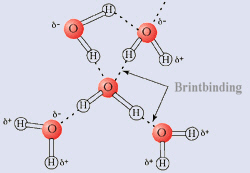
Vandmolekyler er bundet sammen gennem hydrogenbindinger. Hydrogenbindinger opstår når et hydrogen (brint), som er kovalent bundet til enten et oxygen (ilt), sulfur (svovl) eller nitrogen (kvælstof) atom nær ved en elektrofil atom, såsom (ilt). Elektrofil atomet ”trækker” brinten tættere til sig. Slutresultatet er, at hydrogen (brint) nu deles (uligeligt) mellem atomet hvortil det er kovalent bundet og elektrofil atomet, som det er tiltrukker (O-H..O).
Da vand ene og alene er hydrogen kovalent bundet til ilt og elektrofil ilt, er det let at se, hvorfor der er så mange brint forbindelser i vand.
Molekylerne i vandet er i konstant bevægelse, og brint afbrydes og forbindes konstant. Den gennemsnitlige brintforbindelse sker på bare en-trilliontedel af et sekund (10-12 s)!
- ![]() Brintbindinger i vand.
Brintbindinger i vand.
Hver brint obligation (binding) har et gennemsnitligt energiforbrug på 20 kJ / mol. Det er langt mindre end en O-H kovalent binding, hvilket er 460 kJ / mol.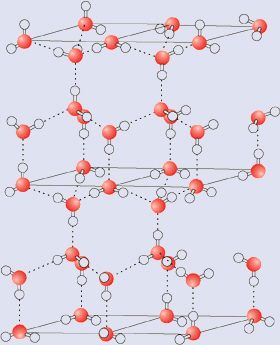
Selv gennem en konkret brintobligation er det relativt svagt, det store antal hydrogenbindinger, der findes i vand, som trækker molekylerne sammen, giver vandet dets særlige tæthed og faseovergangens egenskaber.
Det er meget ligesom historien om Gulliver's Travels, da Gulliver vågnede på øen Lilliput, kunne han finde sig selv bundet med mange små strenge. Hver streng var individuel svag, men sammen var de nok til at binde Gulliver.
I gennemsnit vil en flydende vand molekyle have 3 ud af 4 mulige hydrogenbindinger, hvilket skyldes, at molekylerne i væsken er i konstant bevægelse.
I is vil vandet formes gennem alle 4 mulige hydrogenbindinger, fordi molekylerne i en fast form, låser bevægelsen fast. Vandmolekyler er længere fra hinanden i is, end de er i flydende tilstand. Isen er derfor ikke så tæt som flydende vand. Det er grunden til isbjerge i havet, og hvorfor isen flyder i en drik. Det står meget i modsætning til det normale forhold, mellem en sammensat fast og flydende form, med fast form har normalt en højere massefylde.
Mens den usædvanlige tæthed/vægtfyldes egenskaber af vand ikke ser ud til at være vigtigt i biologiske reaktioner, er det meget vigtigt for livet på jorden. Hvis isen ikke flyder, vil det, selv i meget kolde vandmasser, synke, og fjerne dets isolerende effekt fra vandoverfladen. Søer, floder og store dele af verdenshavene ville dermed fryse helt fra bunden. Verden ville være et meget anderledes sted, og langt mindre egnet til liv.
Vand er en god solvens
Den polære karakter af vand, med dets delvise positive og delvise negative dipol, gør det muligt at opløse opladede molekyler (ioner) ganske nemt. Vand er således en glimrende solvens for ladede forbindelser. Den positive side af vandet er omgivet af negative ladede molekyler, og den negative ladede side af vandet, er omgivet af positive ladede molekyler. 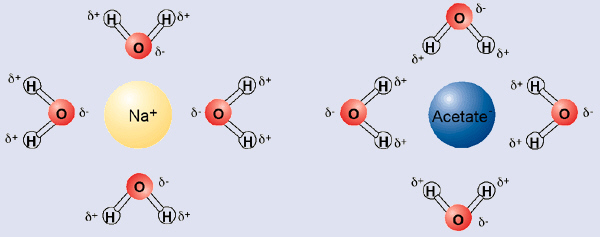
På denne måde skaber vand "solvationskaller" omkring ioner. Vand kan også let opløse andre polære molekyler, selv om de ikke er positive eller negative ladede.
Vandets opløsningsegenskaber giver mulighed for at opløse metaller og buffering systemer, som er meget vigtige for livets arbejdsheste, enzymer. På den anden side siges det, at "olie og vand ikke blandes", hvilket er rigtigt - vandet kan ikke opløse olie. Dette skyldes, at fedtstofferne er ikke-polære. Ikke-polære stoffer (som mangler dipoler) kaldes også hydrofobe. Hydrofobe stoffer slutter sig sammen for at udelukke vand, som de bedst kan. Dette er grunden til du ser olie dråber i vand. Det er også vigtigt for stabilitet og strukturen af enzymer. ![]()