Nobelprisen i Hydreringsvidenskab, 2003
Dansk bearbejdelse © Poul-E. Nielsen, Sc.D.
Alt levende er sammensat af celler. Et enkelt menneske har lige så mange celler som der er stjerner i universet, omkring hundredetusinde millioner (eller endnu flere). De varierende celler - som for eksempel muskelceller, nyreceller og nerveceller - fungerer sammen på en indviklet måde i hver af os. Gennem en banebrydende opdagelse omkring vand og ion kanaler i celler, bidrog Nobelpristagerne Peter Agre og Roderick MacKinnon den 8. oktober 2003 med en fundamental kemisk viden, baseret på cellefunktionerne. De har åbnet vore øjne til at forstå de fantastiske familiære molekylers maskineri: kanaler, porte og ventiler, hvilket er en nødvendighed for at cellerne kan fungere.
Det har været kendt længe, at selv for at modstå trykket i cellerne, er det vigtigt at vandet kan passere gennem cellevægen. Forekomsten og funktionen af disse porer har længe været uløst, som et af de klassiske uløste problemer indenfor biokemi. Men omkring 1990 opdagede Peter Agre den første vandkanal. Lige som så meget andet i livet, blev kanalen opdaget omkring et protein.
Vandmolekyler er ikke blot en genstand som passerer ind og ud af cellerne. For at milliarder af celler kan fungere, kræves der koordinering, et samarbejde. Koordinering mellem cellerne er altså en nødvendighed. Signalerne som bliver afsendt i og mellem cellerne indeholder ioner, eller små molekyler. De starter en strøm af kemiske reaktioner som får vore muskler til at spændes, giver vand til vore øjne - de kontrollerer virkelig hele vor kropsfunktion. Signalerne i vor hjerne er ligeledes involveret omkring sådanne kemiske reaktioner. Når vi står på en tå, starter det en signalbevægelse op til hjernen. Langs en kæde af nerveceller, gennem et samspil mellem de kemiske signaler og de aktuelle ioner, overbringes informationen fra celle til celle ligesom en stav i et stafetløb.
Det var først i 1988 at Roderick MacKinnon for første gang fik succes med at vise ion kanaler, en bedrift, som sammen med Agres opdagelse af vand kanaler, åbnede helt nye forskningsområder indenfor biokemi og biologi.
Den medicinske konsekvens af Agres og MacKinnon's opdagelser er ligeledes meget vigtig. Et antal sygdomme kan tilskrives en dårlig funktion i vandet og ion kanalerne i den menneskelige krop. Med den fundamentale viden om hvordan de ser ud og hvordan de fungerer, giver nye muligheder for at udvikle nye og langt mere effektive lægemidler (farmaceutiske).

Større billede » |
Fig ur 1. Den delte væg mellem cellen og verden udenfor - inklusive andre celler - er langt fra en uimodtagelig skjold. Det er derimod perforeret med varierende kanaler. Mange af disse er specielt tilpasset et specifikt ion eller molekyle og tillader ikke andre typer at passere. Til venstre ser vi en vandkanal og til højre en ion kanal. |
Vand Kanaler
Jagten efter vandkanaler:
Allerede i midten af det nittende århundrede forstod man, at der måtte være åbninger i cellemembraner for at vand og salt måtte kunne passere.
I midten af 1950erne opdagede man, at vand hurtigt kunne passere ind og ud af cellerne gennem porer, som kun tillod vandmolekyler at slippe igennem.
Gennem de næste 30 år blev det studeret i detaljer og konklusionen blev, at der måtte være nogle typer af selektive filtre som forhindrede ioner i at passere gennem hinden (membranen) mens vandmolekyler kunne slippe frit igennem. Milliarder af vandmolekyler passerer igennem en enkelt kanal i sekundet!
Selvom det var kendt, var det ikke før 1992 at det lykkedes nogle at identificere, hvordan denne molekylære maskinfabrik så ud; det vil sige at identificere hvad protein eller proteiner dannede i selve kanalen. I midten af 1980erne studerede Peter Agre adskillige membran proteiner fra røde blodlegemer (blodceller). Han fandt også en af disse i nyrerne. Ved at bestemme begges peptiske sekvens og samarbejdet i DNA sekvensen fandt han, at det måtte være proteinet, som mange før ham havde søgt, den cellulære vandkanal.
Agre testede sin hypotese i et enkelt eksperiment (figur 2), hvor han sammenlignede celler som indeholdt proteiner med celler, som ikke indeholdt proteiner. Når cellerne blev placeret i en vandopløsning, absorberede de celler som havde proteiner i deres membran vandet via osmosis og hævede sig op, mens de som ikke havde protein i deres membran, slet ikke blev påvirket.
Hvad er osmosis?
Væsketrykket i plante- og dyre celler opretholdes gennem osmosis. I osmosis passerer små molekyler (såsom vand) gennem en semi-gennemtrængelig membran. Hvis membranen ikke tillader makromolekyler eller salte, som er i en højere koncentration på den ene side af membranen, vil små molekyler (vand) slippe igennem for at "fortynde" substansen som ikke kan passere igennem membranen. Det osmotiske tryk opstår således gennem en forbindelsen mellem cellerne, og er også derfor at celler ofte er opsvulmet og stift, som for eksempel en blomsterstilk.
 |
Større billede » |
Fig ur 2. Peter Agres eksperiment med celler med og uden vandprotein. Vandproteinet er en nødvendighed for at cellerne kan absorbere vand og svulme op. |
Peter Agre vidste også at kviksølv ioner forhindrede cellerne i at optage og at frigive vand, og han viste at vandet i hans nye protein ligeledes blev afbrudt på samme måde, når det blev inficeret med kviksølv. Det gjorde ham sikker på at han havde opdaget det, som vi kalder en ny vandkanal. Agre navngav proteinet
aquaporin, "vandporer".Hvordan fungerer vandkanalen? Et spørgsmål i form og funktion.
Sammen med andre forskere, frigav Agre i året 2000 det første højt opløselige billedet af en tredimensionelt struktur af aquaporin. Via disse data blev det muligt, indgående i detaljer at se hvordan en vandkanal fungerer. Hvordan bærer det sig ad med at tillade vandmolekyler at passere og ikke andre molekyler eller ioner? Membranen tillader for eksempel ikke at lække protoner. Det er yderst vigtig, fordi forskellen i proton koncentrationen indeni og udenfor cellen er grundlaget for det cellulære energi-oplagrings system.
Selektivitet er en central egenskab af kanalen. Vandmolekyler finder deres vej gennem en snæver kanal, ved at orientere sig i den lokale elektriske felt, som er dannet af atomer i kanalvægen. Protoner (eller nærmere oxonium ioner, H3O+) stoppes på deres vej og forkastes, fordi de er positiv ladet.

Større billede » |
Fig ur 3. Passagen af vandmolekyler gennem aquaporin AQP1. På grund af de positive ladninger i midten af kanalen, afbøjes de positiv ladede ioner, såsom H3O+, hvilket forhindrer protonlækage gennem kanalen. |
Den medicinske betydning af vandkanalen:
Gennem de sidste ti år er vandkanaler blevet fremkaldt ved hjælp af højaktuel forskning. Aquaporins er afprøvet med en stor familiær proteinslægt. De eksisterer i bakterier, planter og dyr. Der er fundet mindst elleve forskellige varianter i det menneskelige legeme.
Funktionen af disse proteiner er nu kortlagt i bakterier, planter og dyr med fokus på deres fysiologiske rolle. I mennesket spiller vandkanalen en vigtig rolle sammen med andre organer, nyrerne.
Nyrerne er et genial apparat som fjerner substanser, som kroppen ønsker at udskille. I dets bukninger (udtrykt glomeruli), giver det mulighed for at sive, vand, ioner og andre små molekyler, som afgår fra blodet som 'primær' urin. Gennem 24 timer produceres omkring 170 liter primær urin. Det meste af det genanvendes via en serie af listige mekanismer, så slutresultatet bliver at der udskilles en liter urin fra kroppen dagligt.
Fra glomeruli passerer primær urin gennem et bukket rør, hvor omkring 70 % af vandet genanvendes til blodet via aquaporin AQP1. I enden af røret genanvendes andre 10 % vand med en lignende aquaporin AQP2. Afsides herfra genanvendes også natrium, kalium og klorid til blodet. Anti-urindrivende hormon (vasopressin) stimulerer transporten af AQP2 til cellemembranen i rørenes vægge og følgelig heraf en forøget udskillelse. Mennesker med mangel på disse hormoner er påvirket af sygdommen diabetes insipidus med en daglig urinladning på 10-15 liter.
Ion kanal
Cellens signal med salt!
Den tyske apoteker, Wilhelm Ostwald (Nobelprisen i kemi 1909) foreslog i 1890 at elektriske signaler, målt i levende væv, kunne fremkaldes af ion bevægelser, ind og ud af cellemembranen. Denne elektro-kemiske ide opnåede hurtig accept blandt videnskabsfolk. Opfattelsen af eksisterende typer af snævre kanaler dukkede op i 1920erne. To britiske videnskabsmænd, Alan Hodgkin og Andrew Huxley, gjorde et større fremskridt i 1950erne, med hvilken de i 1963 blev tildelt Nobelprisen i Physiology or Medicine. De to videnskabsmænd viste hvordan ion transporten gennem nervecelle membraner producerede et signal som gav besked fra celle til celle, akkurat som staven i et stafetløb.
Det er primært natrium og kalium ioner, Na+ og K+ som er aktive i disse reaktioner.
Således gik der så meget som halvtreds år, før der var en veludviklet kendskab til den centrale funktion af ion kanalerne. Det måtte være muligt for dem at tillade en valgt ion type at passere igennem, men ikke andre. Ligeledes måtte det være muligt for kanalerne at åbne og lukke og nogle gange at lede ionerne i en bestemt retning. Men hvorledes denne molekylære maskineri i virkeligheden fungerede, var i lang tid et rent mysterium.
Igennem 1970erne blev det muligt at vise, hvordan det var muligt for ion-selektive kanaler kun at tillade passage af ioner, da de var udstyret med en slags 'ion filter'. Der var en særlig interesse for at finde kanalen som tillader kalium ioner men ikke natrium ioner at passere - selvom natrium ioner er mindre end kalium. Man havde en mistanke om at ilt (oxygen) atomer i proteinet spillede en vigtig rolle som 'stedfortræder' for vandmolekyler, da kalium ionen omringer sig selv i vandopløsningen og fra hvilken det må befri sig selv, for at komme igennem kanalen.
Men yderligere fremskridt med denne hypotese var vanskelig - hvad der nu var brug for var ganske enkelt højt opløselige billeder af typen, som kun røntgen krystalfotografi kunne give. Problemet var at det er ekstrem vanskelig af afgøre protein membranens struktur med denne metode, og ion kanalerne var ikke nogen undtagelse i den forbindelse. Protein membraner fra planter og dyr er mere komplicerede og vanskeligere at arbejde med, end disse fra bakterier. Ved brug af bakteriel proteinkanal som ligner et menneskes ion kanal meget, var det måske en måde at komme videre på.
Mange forskere forsøgte omsonst. Gennembruddet kom fra en uventet kant. Efter at Roderick MacKinnon have studeret biokemi, vendte han sig til medicin og kvalificerede sig til medicinsk læge. Efter at have arbejdet som læge i nogle år, blev han grebet af interessen for ion kanalerne, og startede sin egen forskning på dette område: "Min naturvidenskabelige karriere startede da jeg var i starten af 30erne". Men hans karriere tog en hurtig afslutning. Da det var realistisk, at der var brug for bedre og højere opløsningsstruktur for at kunne forstå ion kanalernes funktion, besluttede han at lære det fundamentale i røntgen krystalfotografi. Det var blot få år før han overraskede hele den videnskabelige forskningsverden ved at præsentere en struktur af ion kanaler. Det var i april måned, 1998.
Kort over den første ion kanal - atom for atom
MacKinnon besluttede sig i 1998 for at kalde den første højt opløselige struktur af ion kanaler fra bakterien Streptomyces lividans for KcsA. MacKinnon afslørede for første gang, hvordan en ikon kanal fungerer på atomisk niveau. Nu kunne det i detaljer studeres, hvordan det såkaldte ion-filter - som tillader kalium at passere igennem mens det stopper natrium ioner - fungerer. Det var ikke blot muligt at opklare, hvordan ioner passerer igennem kanalen, de kunne også ses i krystalstrukturen - omringet af vandmolekyler, akkurat som før de passerede ion filtret, og når de møder vandet på den anden side af filtret (figur 4).
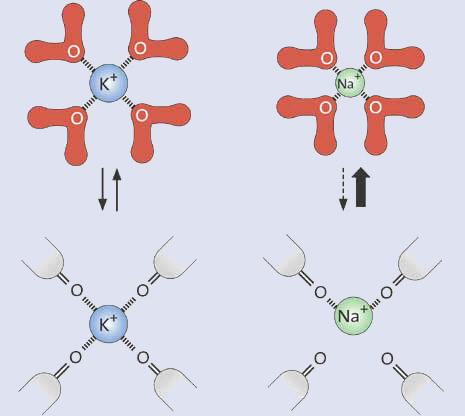
MacKinnon kunne forklare hvorfor kalium ioner, men ikke natrium ioner tillades passage gennem filtret: fordi afstanden mellem kalium ioner og ilt (oxygen) atomer i filtret er den samme som afstanden mellem kalium ioner og ilt (oxygen) atomer i vandmolekyler, som er omringet af kalium ioner når det er udenfor filtret. Således kan det sive igennem filtret uden modkandidat. Natrium ioner, som er mindre end kalium ioner, kan imidlertid ikke passere igennem kanalen. Årsagen hertil er, at det er fordi det ikke anbringes mellem ilt (oxygen) atomer i filtret og derfor forbliver i vandopløsningen. Kanalens mulighed for at afklæde kalium ionen i vandet og give det tilladelse til at passere uden omkostninger, er en form for selektiv katalysator flytning.
Cellen skal ligeledes være i stand til at kontrollere åbningen og lukningen af ion kanalerne. MacKinnon har vist at indeværende er opnået via en låge (gate) i bunden af kanalen, hvilken har en molekylær "sensor" for åbning og lukning. Censoren er beliggende tæt ved lågen. Bestemte sensorer reagerer på bestemte signaler, som for eksempel ved en forhøjet koncentration af kalcium ioner, hvor en elektrisk spænding over celle membranen binder signal molekylet. Ved at sammenknytte forskellige censorer til ion kanalen, er der oprettet kanaler som reagerer på en stor mængde forskellige signaler.
Fig ur 4. Ion kanalen tillader passage af kalium ioner, men ikke natrium ioner. Ilt (oxygen) atomerne i ion filter miljøet er meget lignende vandmiljøet udenfor filtret. Cellen skal kontrollere åbning og lukning af kanalen.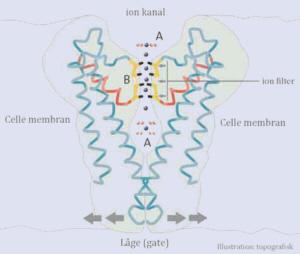 |
Større billede » |
UDENFOR ION FILTRET (A) |
|
IN DE I ION FILTERET (B)For kalium ioner er afstanden til ilt (oxygen) atomer i ion filtret den samme som i vand. | Natrium ioner, hvilke er mindre, lader sig ikke indpasse mellem ilt (oxygen) atomer i filtret. Det forhindrer dem i at sive gennem kanalen. |
Forstå sygdomme
Membrankanaler er en forudsætning for alt levende på denne planet. I den forbindelse er en større forståelse for hvad funktionen udretter basis for at kunne forstå mange sygdomme. Dehydrering af varierende slags og følsomheden for varme er forbundet med effektiviteten af aquaporins. Gennem de seneste år med hedebølger i Europa, som resulterede i mange dødsfald, var årsagen i mange tilfælde forbundet med problemer i at opretholde et legemligt væskebalance. I disse tilfælde er aquaporins af afgørende betydning.
Forstyrrelse i ion kanalernes funktion, kan føre til seriøse alvorlige sygdomme i nervesystemet, for eksempel hjertemuskulaturen. Det gør ion kanalen uhyre vigtig for medicinalindustrien ved fremstilling af lægemidler - men kære læser, forstå vigtigheden af "den korrekte væskebalance" og undgå sådanne sygdomme. Drik mindst otte glas ioniseret alkaline vand daglig.
| Laurbær modtagere: | |
| Peter Agre Department of Biological Chemistry 420 Physiology Building Johns Hopkins University School of Medicine 725 North Wolfe Street Baltimore Maryland 21205 USA | US citizen. Born 1949 (54 years) in Northfield, Minnesota, USA. B.A. at Augsburg College, Minneapolis, chemistry major, 1970. M.D. at Johns Hopkins University School of Medicine in Baltimore, 1974. Since 1993, Professor of Biological Chemistry and Professor of Medicine at Johns Hopkins School of Medicine. |
| Roderick MacKinnon Howard Hughes Medical Institute Laboratory of Molecular Neurobiology and Biophysics Rockefeller University 1230 York Avenue, New York, New York 10021 USA | US citizen. Born 1956 (47 years). Grew up in Burlington outside Boston, USA. B.A. at Brandeis University, Boston, 1978. M.D. at Tufts Medical School in Boston, 1982. Since 1996, Professor of Molecular Neurobiology and Biophysics at The Rockefeller University in New York. |